- Una batería es una asociación de celdas secundarias.
- Las celdas secundarias convierten la energía química en eléctrica y viceversa (proceso de óxido-reducción)
- Pocos pares de elementos químicos son capaces de funcionar en forma reversible, estable y cíclicamente. Los pares mas comunes son principalmente el Plomo-Ácido y el Niquel-Cadmio, y su aplicación en la fabricación de baterías data de hace mas de 100 años.
- Una batería de plomo-ácido trabaja químicamente de la siguiente manera.
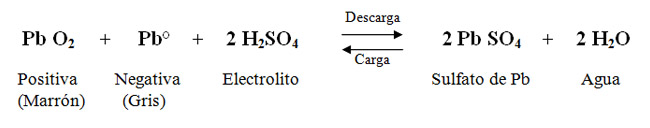
- La descarga produce Sulfato de Plomo que se deposita en ambas placas, consume ácido y produce agua, en consecuencia la densidad disminuye y lo mismo ocurre con la tensión. El sulfato se cristaliza con el tiempo, generando temperatura y resistencia a la recarga, por ende no hay que dejar baterías descargadas.
- La tensión a circuito abierto de una batería de plomo-ácido (Voc) es directamente proporcional a la densidad del electrolito (d) en kg/l.

La Voc no puede medirse inmediatamente después de terminada una carga de la batería, debe esperarse de 12 a 24 hs, para que la batería se estabilice químicamente.
- Curva típica de una batería

Curvas de Descargas de una Batería
